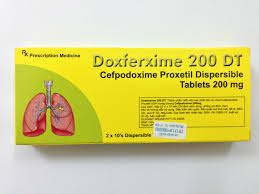
(ĐSPL) - Thuốc viên nén phân tán Doxferxime 200 DT (Cefpodoxime Proxetil Dispersible Tablets 200 mg) do Dược phẩm Trung ương 2 nhập khẩu, bị đình chỉ lưu hành do không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hoà tan.
Theo Cục Quản lý Dược, căn cứ công văn số 310/VKNT- KHTH ngày 21/07/2015 của Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh gửi kèm phiếu kiểm nghiệm số 0381/VKN-KT2015 ngày 21/07/2015 về thuốc Viên nén phân tán Doxferxime 200 DT (200 mg), số lô VN9143, HĐ: 08/02/17, SĐK: VN-10902-10 do Công ty Elegant Drugs Pvt., Ltd. (India) sản xuất, Công ty TNHH MTV Dược phẩn Trung ương 2 nhập khẩu, mẫu thuốc do Viện kiểm nghiệm thuốc TP. HCM lấy tại Bệnh viện Đa khoa tỉnh Vĩnh Long. Thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu độ an toàn.
Cục Quản lý Dược, đình chỉ lưu hành toàn quốc thuốc viên nén phân tán Doxferxime 200 DT (200 mg) nói trên. Công ty TNHH MTV dược phẩm Trung ương 2 phối hợp với nhà cung cấp và phân phối thuốc, trong thời gian 5 ngày, gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc viên nén nói trên do không đạt tiêu chuẩn chất lượng.
Doxferxime 200 DT (Cefpodoxime Proxetil Dispersible Tablets 200 mg) do Dược phẩm Trung ương 2 nhập khẩu, bị đình chỉ lưu hành do không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hoà tan. |
Sau đó, gửi báo cáo thu hồi về Cục Quản lý Dược trước ngày 6/9/2015, hồ sơ thu hồi bao gồm số lượng sản xuất, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định tại Thông tư số 09/2010/TT-BYT ngày 28/04/2010 của Bộ Y tế hướng dẫn việc quản lý chất lượng thuốc.
Theo ông Đỗ Văn Đông-Phó Cục trưởng Cục Quản lý Dược, thuốc này bị đình chỉ lưu hành do không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hoà tan. Cục Quản lý Dược yêu cầu Công ty TNHH MTV Dược phẩm Trung ương 2 nhập khẩu phối hợp với nhà cung cấp và phần phối gửi báo cáo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên và báo cáo về Cục trước ngày 6/9/2015.
Cục Quản lý Dược cũng giao Sở Y tế các tỉnh thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
Cục Quản lý Dược cũng ban hành quyết định xử phạt vi phạm hành chính về thuốc đối với Công ty Sance Laboratoriea Pvt Ltd India - nhà cung cấp, đại diện cho Công ty Aegen Bioteck Pharma Private Limited India - nhà sản xuất.
Còn mới đây, Cục Quản lý Dược cũng ban hành quyết định xử phạt vi phạm hành chính về thuốc đối với Công ty Sance Laboratoriea Pvt Ltd India - nhà cung cấp, đại diện cho Công ty Aegen Bioteck Pharma Private Limited India - nhà sản xuất. Đại diện là bà Nguyễn Thị Hồng Liễu.
Hành vi vi phạm được xác định là sản xuất, kinh doanh thuốc EMLOCIN 5 (Amlodipine 5mg) SĐK VN-14836-12, lô 2809, ngày sản xuất 1/1/2015, hạn sử dụng 31/12/2017 không đạt yêu cầu chất lượng mức độ 3 theo quy định của pháp luật.
Hình thức xử phạt với mức tiền là 50 triệu đồng. Biện pháp khắc phục hậu quả là: Công ty Sance Laboratoriea Pvt Ltd India phối hợp với Công ty CP XNK y tế TP. HCM và các đơn vị liên quan thực hiện thu hồi và hủy toàn bộ số lô thuốc kém chất lượng nêu trên theo đúng quy định.
AN NHIÊN